线虫是重要的模式生物,迄今为止,在线虫中的研究已斩获三届诺贝尔奖。线虫之父Sydney Brenner和他的四位员工John Sulston、Robert Horvitz、Andrew Fire与Martin Chalfie均因在线虫中的研究先后获得了诺贝尔奖。2006年,诺贝尔生理或医学奖颁给了两位美国科学家:Andrew Fire和Craig Mello,以表彰他们在线虫中揭示了双链RNA(dsRNA)引起RNA干扰(RNAi)的分子机制。RNAi在线虫中有一个显著特性:注射或局部表达双链RNA(dsRNA),沉默信号能扩散到线虫所有非神经细胞中,包括生殖细胞,导致沉默信号能够传递给下一代。这种RNAi传播现象被称为系统性RNAi。为了揭示其中的奥秘,哈佛大学Craig Hunter教授在2002年和2003年相继在SCIENCE期刊发表论文,揭示跨膜蛋白SID1是线虫系统性RNAi所必需的核酸转运通道(channel)。
人和哺乳动物虽然没有系统性RNAi现象,但具有SID1的直系同源蛋白SIDT1和SIDT2。研究发现SIDT1/2广泛参与多种核酸转运过程,包括介导RNA/DNA进入溶酶体自噬、介导病毒dsRNA从晚期内体进入细胞质引起天然免疫反应、介导哺乳动物胃对植物或食物中天然miRNA的直接吸收等,是开发口服小RNA疗法及研发小RNA药物的重要靶点。此外,SIDT2还广泛参与脂质代谢、葡萄糖代谢、线粒体质量调控、溶酶体功能、阿尔兹海默症、帕金森症等多种生理与病理进程,使得其作用机理变得更为复杂与神秘。由于SID1家族与任何已知的通道蛋白(channel)或转运体蛋白(transporter)都没有同源性,原子结构信息的缺失严重制约了对其作用机理的理解和靶向药物的开发。
2023年6月15 日,伟德betvlctor体育官方网站龚德顺研究员,联合清华大学闫创业教授和伟德betvlctor体育官方网站陈佺教授,合作在Nature Communications杂志在线发表了题为Structural insight into the human SID1transmembrane family member 2 reveals its lipid hydrolytic activity的研究论文。该论文首次报道了人源SIDT2的高分辨率冷冻电镜结构,发现SIDT2并不是通道蛋白,表明其可能以转运体形式发挥核酸转运功能。通过结构分析和功能实验,进一步揭示SIDT2是一类膜内脂质水解酶。该研究为揭示SID1家族的作用机理迈出了重要一步,为理解SID1家族结构与功能的关系提供了全新的视角。

研究者首先在Hela细胞中证明人源SIDT2具有核酸转运功能,随后通过冷冻电镜的方法解析了全长人源SIDT2在三种不同条件下的高分辨率冷冻电镜结构:apoSIDT2-pH 7.4,apoSIDT2-pH 5.5和SIDT2-pH 5.5 plus miRNA。结构显示:SIDT2呈现全新的折叠模式,由两个富含β折叠片的胞外/腔结构域、一个含有11次螺旋的跨膜结构域和一个C端结构域组成,并形成了稳定的二聚体。跨膜区在距离胞外/腔膜表面约6Å处具有一个锌离子催化中心,由三个组氨酸、一个天冬氨酸和一个丝氨酸组成。不同pH条件下的SIDT2构像完全相同,表明SITD2对pH不敏感。遗憾的是,加入miRNA后,并未发现明显的RNA密度。
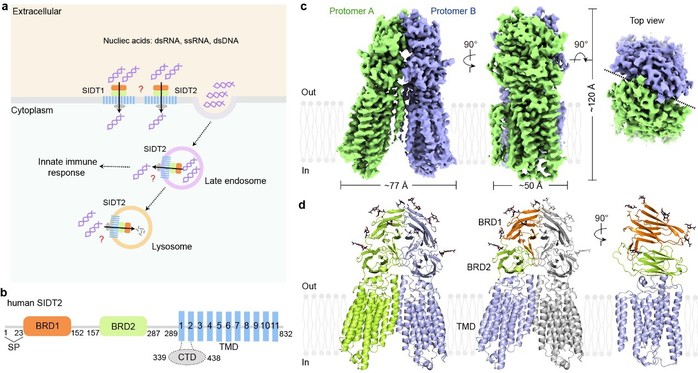
人源SIDT2的冷冻电镜结构
通过DALI搜索相似结构,发现SIDT2具有与碱性神经酰胺酶和脂联素受体类似的锌离子催化中心。进一步通过酶活实验证明,SIDT2可以将C18神经酰胺水解为鞘氨醇和脂肪酸,其催化速率与碱性神经酰胺酶、脂联素受体以及γ-secretase等膜内水解酶处于同一数量级。此外,SIDT2不能水解具有更大头部基团的C18鞘磷脂,表明其具有底物特异性。以上结果暗示SIDT2的脂质水解酶活性可能具有重要生理意义,为理解SIDT2在脂质代谢中的作用机理提供了全新的思路。
综上所述,该研究首次揭示了SID1家族的原子结构,并表征了其膜内脂质水解酶特性,但SID1家族识别和转运核酸的分子机制仍有待进一步研究。
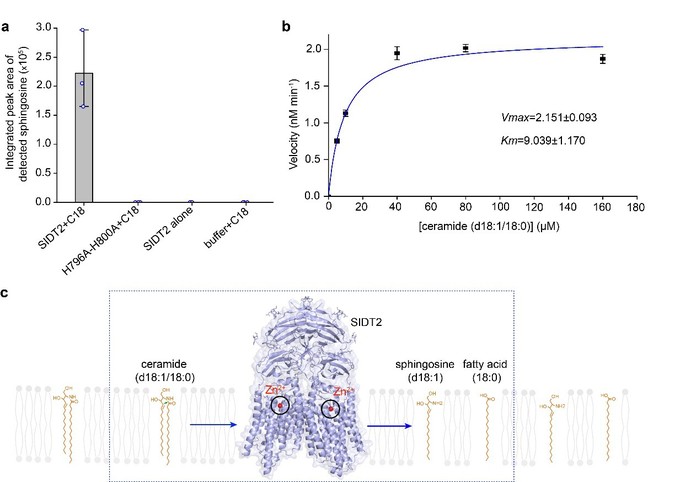
SIDT2是一类膜内脂质水解酶
伟德betvlctor体育官方网站博士后钱丹丹和清华大学博士后丛野为论文的共同第一作者,伟德betvlctor体育官方网站博士生王润浩参与了部分工作,伟德betvlctor体育官方网站龚德顺研究员、清华大学闫创业教授和伟德betvlctor体育官方网站陈佺教授为论文的共同通讯作者。该工作受到国家自然科学基金委和伟德betvlctor体育官方网站中央高校基本科研业务费的支持。
文章链接:https://www.nature.com/articles/s41467-023-39335-2



