细胞呼吸是生物体重要的代谢活动,为生命活动提供了直接的能量物质三磷酸腺苷(ATP),其中线粒体氧化磷酸化(oxidative phosphorylation, OXPHOS)系统是处于细胞代谢的中枢位置,包括五个酶复合物(线粒体呼吸链复合物Ⅰ- IV和ATP合成酶)和两个移动的电子载体(细胞色素c和泛醌)。复合物Ⅰ和复合物Ⅱ分别氧化NADH和琥珀酸,同时将电子传递给泛醌;泛醌被复合物Ⅲ还原生成氢醌,同时将电子传递给细胞色素c,最后电子传递给结合在复合物Ⅳ中的氧气分子并还原生成水分子。电子在呼吸链传递过程中,伴随复合物Ⅰ、Ⅲ和Ⅳ将质子从线粒体基质转移到线粒体膜间隙,产生的跨膜质子梯度驱动ATP合酶(亦称为复合物Ⅴ)生成ATP。呼吸链损伤包括其组分发生突变会引起一系列生理功能紊乱和代谢相关的疾病。研究线粒体呼吸链膜蛋白复合物组成、组装及结构,对于理解呼吸链电子传递机制、氧化还原偶联质子跨膜梯度形成过程、呼吸链与机体生理疾病的联系及药物设计等都具有重要意义。
2023年4月25日,公司贡红日研究员、饶子和院士联合上海科技大学、广州实验室、内蒙古大学、昆士兰大学、中国科学技术大学等多个单位在国际著名学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America, PNAS)在线发表题为“Structure of the human respiratory complex II” 的研究论文。该团队解析了人源线粒体呼吸链复合物II 2.86 Å高分辨率的电镜结构,为其功能机制及相关疾病的理解和靶向药物的开发奠定了重要基础。

呼吸链复合物Ⅱ是一种关键的蛋白质复合物,又称琥珀酸脱氢酶(Succinate dehydrogenase , SDH),连接了两个重要的生理代谢过程:三羧酸循环(TCA)和氧化磷酸化(OXPHOS)。研究发现,复合物Ⅱ突变会导致线粒体疾病和肿瘤的发生;复合物Ⅱ亦是白血病等疾病的潜在药物靶点。然而,人源复合物Ⅱ的结构至今仍未被解析,这限制了对其功能的进一步理解。在该研究中,联合研究团队利用冷冻电镜技术解析人源复合物II的结构,阐明了其结构特征并提出了电子传递机制。同时,研究人员借助分子动力学模拟发现,尽管人源线粒体呼吸链复合物II与猪心线粒体呼吸链复合物II间的电子传递机制是保守的,但是前者的构象更加稳定。
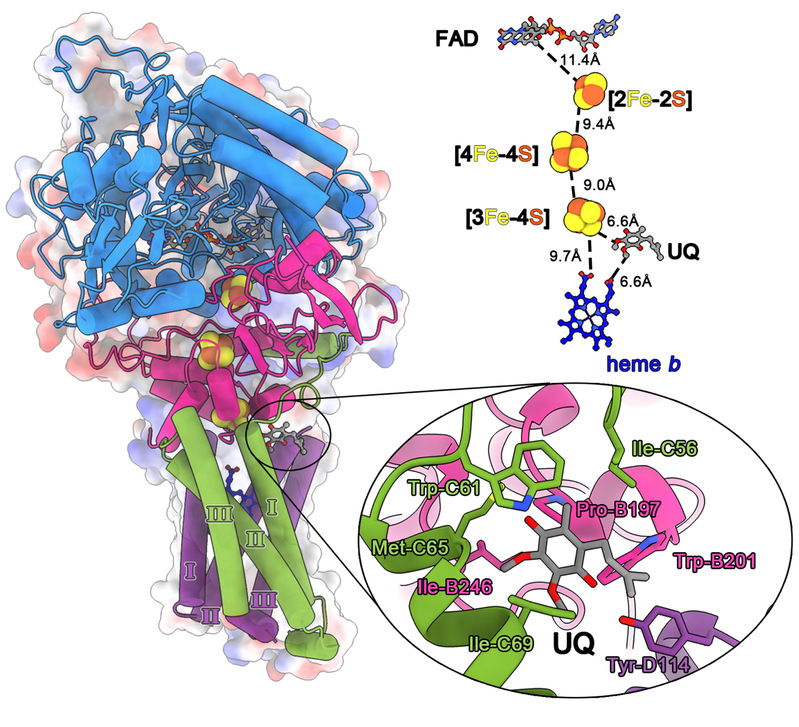
人源复合物II的三维结构
研究人员同时分析了相关临床突变致病的分子作用机制,发现报道的突变体影响复合物结构的稳定性,为疾病的理解和治疗提供了新的见解。此外,研究表明结核分枝杆菌等分枝杆菌的呼吸链复合物II是潜在的药物靶点。本研究也将为开发靶向性更好、副作用更低的抗结核药物奠定基础。
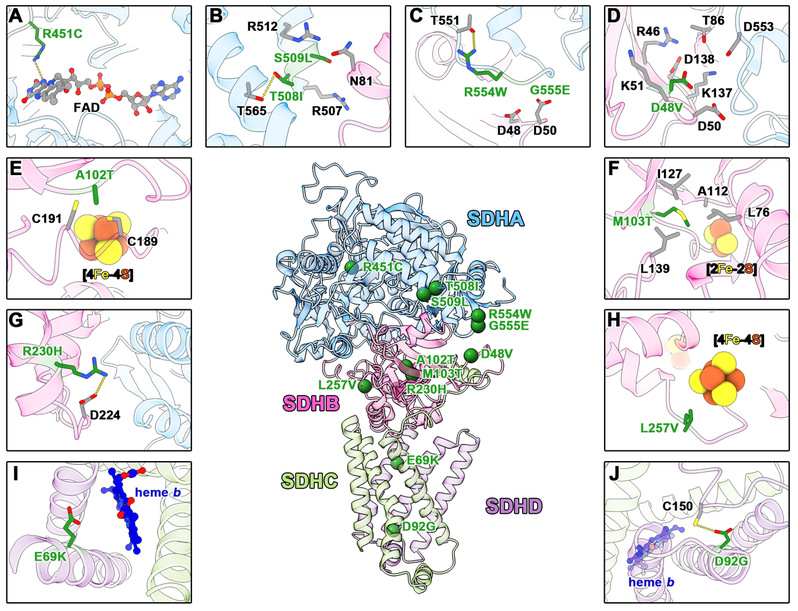
人源复合物II相关的临床突变位点分析
伟德betvlctor体育官方网站博士研究生杜占强、内蒙古大学讲师周晓婷为本文的共同第一作者,南开老员工命科学学院贡红日研究员、饶子和院士、上海科技大学免疫化学研究所高岩副研究员、广州实验室刘凤江副研究员为共同通讯作者。中国科学技术大学田长麟教授、于璐副研究员提供电子顺磁共振实验支持;广州实验室陈红明研究员、冉挺副研究员提供分子动力学模拟实验支持。该工作得到了国家重点研发计划青年科学家项目、国家自然科学基金委优秀青年科学基金的资助。广州实验室影像成像子平台和上海科技老员工物电镜平台提供了重要的技术支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2216713120



